
Oksid
Oksid — Biri oksigen olmaqla iki elementdən ibarət olan mürəkkəb maddələrə oksidlər deyilir. Oksidlərdə oksigenin oksidləşmə dərəcəsi "–2" olur. Yalnız Fe3O4 dəmirin qarışıq oksidində 8/3 valentlik göstərir ancaq başqa element atomları ilə birləşərkən. Məsələn: Na — O – Na. Oksigen atomlarının öz aralarında rabitə yaratdığı iki elementli mürəkkəb maddələr peroksidlər adlanır. Peroksidlərdə oksigenin oksidləşmə dərəcəsi "-1" olur. Məsələn: Na — O — O — Na — natrium peroksid; H — O — O — H — hidrogen peroksid. NaO2, KO2 superoksidləri və OF2 — birləşməsi oksid deyil. Hazırda He, Ne və Ar-dan başqa bütün elementlərin Oksigenli birləşmələri alınmışdır.
Kimyəvi xassələrinə görə oksidlər duzəmələgətirməyən və duzəmələgətirən oksidlərə bölünür.

Amorf cümlə
Amorf cümlə — Cümlənin adi, kanonik (müəyyən dil üçün məqbul sayılan) üzvlərinə görə bölünə bilməməsi.

Amorf dillər
Amorf dillər — Sözdəyişdirici şəkilçiləri olmayan dillərdir ki, belə dillərdə qrammatik mənalar ya yanaşma əlaqəsi, ya da köməkçi sözlər vasitəsilə ifadə olunur. Məs.: çin dili. Sözün tam mənasında amorf dil yoxdur.

Amorf hal
Amorf hal (A.h)-(yun. amorphos-formasız) maddənin qeyri-kristal quruluşlu bərk halı olub, xassələrin izotropluğu və ərimə nöqtəsinin olmaması ilə xarakterizə olunur. İzotropluq, yəni onların bütün fiziki xassələri (mexaniki, istilik, elektrik, optik və s. xassələri) təbii şəraitdə kristallarınkından fərqli olaraq, maddə daxilində hər hansı istiqamətdə eynidir (bax. Anizotropluq). Temperaturun yüksəlməsi zamanı amorf maddə yumşalır və maye hala tədricən keçir. Bu xüsusiyyət, atom, molekul, ion və onların qruplarının yüz və min period davamında kristallardaki kimi ciddi periodikliyin A.h.-dakı maddələrdə olmaması ilə əlaqədardır. Eyni zamanda A.h.-da maddələrdə qonşu zərrəciklərin yerləşməsində (n.d. yaxın düzülüş, şək., b) uyğunlaşma mövcuddur. Məsafənin böyüməsilə bu uyğunlaşma kiçilir və qəfəs sabitinin bir neçə mislinə bərabər məsafədə itir (bax.

Amorf metallar
Amorf metallar (A.m)-qeyri-kristallik bərk metallar və onların ərintiləridir. Metal (və qeyri-metal) maddələrin amorfluğu təcrübi olaraq kristallar üçün xarakter olan nümunələrin rentgen-, neytron- və elektronoqramlarında difraksiya maksimumlarının olması ilə müəyyən olunur. A.m.-ın əsas alınma üsulları bunlardır: 1) maye ərintinin sürətlə soyudulması (q
≥
{\displaystyle \geq }
105−106 К/с sürətilə); alınan amorf ərinti metallik şüşə adlanır; 2) soyuq altlıqda A.m.-ın nazik təbəqəsi alınana kimi buxarın kondensasiyası və ya atomların tozlandırılması; 3) elektrokimyəvi çökdürmə; 4) kristallik metalları ion və ya neytronların intensiv axını ilə şüalandırma.
A.m.-kristallizasiya prosesinə nisbətən termodinamik dayanıqsız metastabil sistemlərdir; onların mövcudluğu yalnız aşağı temperaturlarda kinetik proseslərin astalığı ilə əlaqədardır. Amorflaşdırıcı aşqarların mövcudluğu A.m.-in stabilləşməsinə kömək edir. Təmiz metallardan alınan amorf nazik təbəqələr ərintidən alınanlardan daha az stabildir, təmiz metallardan metallik şüşələrin alınması üçün isə yüksək sürətli soyutma tələb olunur (~1010 К/с).
İlk dəfə 1960-cı ildə alınmış metallik şüşələr daha çox maraqlıdır. Metallik şüşələrin əsas sinifləri: М1-х Yх — sistemlərи, М — keçid və ya təsirsiz metal, Y-amorflayıcı qeyri-metal və keçid metallarının və ya digər metalların ərintiləri. Tərkiblərin müəyyən intervalında [1–3] metallik şüşələrin əksəriyyəti nadir mexaniki, maqnit və kimyəvi xassələrə malikdir. Bir sıra metallik şüşələrin axıcılıq və şəffaflıq sərhəddi çox yüksəkdir və nəzəri sərhədə yaxındır.

Amorf yarımkeçiricilər
Amorf yarımkeçiricilər (A.y) — amorf maddə olub, yarımkeçirici xassələrinə malikdirlər. A.y.-kovalent A.y.-ə (Ge və Si, GaAs və s. amorf halında), halkogenid şüşələrə (məs., As31 Ge30 Se21 Те18), oksid şüşələrinə (məs., В2О5-P2О5) və dielektrik nazik təbəqələrə (SiOх, AL2О3, Si3 Н4 və s.) ayrılır. A.y.-nə yüksək leqirlənmiş kompensə edilmiş yarımkeçirici kimi də baxmaq olar ki, onun keçiricilik zonasının "dibi" və valent zonasının "tavanı" enib-qalxır, lakin bu dəyişmə (fluktuasiya) qadağan olunmuş zonanın eni
ε
{\displaystyle \varepsilon }
D tərtibindədir.
Keçiricilik zonasındakı elektronlar və valent zonasındakı deşiklər hündür çəpərlərlə ayrılmış potensial relyefin çuxurlarında yerləşən "damcılara" ayrılır. Aşağı temperaturlarda elektrik keçiriciliyi sıçrayışlı xarakter daşıyır. Daha yüksək temperaturlarda A.y.-in elektrik keçiriciliyi elektronların delokallaşmış hal oblastına istiliklə ötürülməsi ilə əlaqədardır. A.y. bir sıra nadir xassələrə malikdirlər ki, bu da onların müxtəlif praktiki tətbiqi üçün imkanlar yaradır. Halkogenid şüşələr spektrin İQ oblastındakı şəffaflığına, yüksək müqavimətinə və fotohəssaslığına görə ötürücü televiziya borularının elektrofotoqrafik lövhələrinin hazırlanması üçün və holoqram yazılarında tətbiq olunur.

Hüceyrə təbəqəsi
Mikrob təbəqəsi — Cücərmə təbəqəsi, embrion inkişafı zamanı əmələ gələn hüceyrələrin əsas təbəqəsidir. Onurğalılarda üç hüceyrə təbəqəsi xüsusilə aydın şəkildə ifadə olunur. Bununla birlikdə, bütün eumetazoanlar (süngərlərə qohum olan heyvanlar) iki və ya üç əsas mikrob təbəqəsi əmələ gətirirlər. Bəzi heyvanlar, iki mikrob təbəqəsi (ektoderma və endoderma) istehsal edərək onları diploblastik edir. Heyvanlar, bu iki təbəqə arasında üçüncü bir təbəqə (mezoderma) əmələ gətirərək onları triploblastik edir. Hüceyrə təbəqələri nəticədə orqanogenez prosesi ilə bütün heyvanın toxumalarını və orqanlarını əmələ gətirir.
== Tarix ==
Kaspar Friedrix Volf, erkən embrionun yarpaq kimi təbəqələrdə quruluşunu müşahidə etdi. 1817 -ci ildə Heinz Kristian Pander, toyuq embrionlarını öyrənərkən üç əsas mikrob təbəqəsi kəşf etdi. 1850-1855 -ci illərdə Robert Remak, hüceyrə təbəqəsi (Keimblat) anlayışını təkmilləşdirərək, sırasıyla xarici, daxili və orta təbəqələrin epidermis, bağırsaq və ara əzələləri və damar sistemini meydana gətirdiyini ifadə etdi. "Mesoderma" termini 1871 -ci ildə Huxley tərəfindən ingilis dilinə, 1873 -cü ildə Lankester tərəfindən "ektoderma" və "endoderma" kimi təqdim edilmişdir.
Həyat təbəqəsi
Həyat təbəqəsi — biosferin əsas hissəsi.
== Ədəbiyyat ==
R.Ə.Əliyeva, Q.T.Mustafayev, S.R.Hacıyeva. “Ekologiyanın əsasları” (Ali məktəblər üçün dərslik). Bakı, “Bakı Universiteti” nəşriyyatı, 2006, s. 478 – 528.

Mikrob təbəqəsi
Mikrob təbəqəsi — Cücərmə təbəqəsi, embrion inkişafı zamanı əmələ gələn hüceyrələrin əsas təbəqəsidir. Onurğalılarda üç hüceyrə təbəqəsi xüsusilə aydın şəkildə ifadə olunur. Bununla birlikdə, bütün eumetazoanlar (süngərlərə qohum olan heyvanlar) iki və ya üç əsas mikrob təbəqəsi əmələ gətirirlər. Bəzi heyvanlar, iki mikrob təbəqəsi (ektoderma və endoderma) istehsal edərək onları diploblastik edir. Heyvanlar, bu iki təbəqə arasında üçüncü bir təbəqə (mezoderma) əmələ gətirərək onları triploblastik edir. Hüceyrə təbəqələri nəticədə orqanogenez prosesi ilə bütün heyvanın toxumalarını və orqanlarını əmələ gətirir.
Kaspar Friedrix Volf, erkən embrionun yarpaq kimi təbəqələrdə quruluşunu müşahidə etdi. 1817 -ci ildə Heinz Kristian Pander, toyuq embrionlarını öyrənərkən üç əsas mikrob təbəqəsi kəşf etdi. 1850-1855 -ci illərdə Robert Remak, hüceyrə təbəqəsi (Keimblat) anlayışını təkmilləşdirərək, sırasıyla xarici, daxili və orta təbəqələrin epidermis, bağırsaq və ara əzələləri və damar sistemini meydana gətirdiyini ifadə etdi. "Mesoderma" termini 1871 -ci ildə Huxley tərəfindən ingilis dilinə, 1873 -cü ildə Lankester tərəfindən "ektoderma" və "endoderma" kimi təqdim edilmişdir.
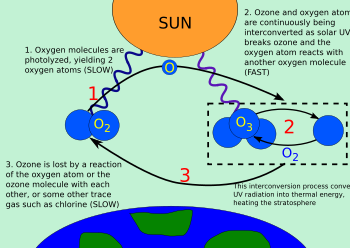
Ozon təbəqəsi
Ozon təbəqəsi — Yer kürəsini günəşin məhvedici radiasiyasından qoruyur. Yer kürəsində olan bütün canlıları ultrabənövşəyi şüalanmadan qoruyan ozon qatının qorunması dünya ölkələri üçün birinci dərəcəli problemlərdən sayılır. Beynəlxalq ozon qatının mühafizəsinin devizi belədir: "Səmanı qoru, özünü qoru, ozon təbəqəsini qoru!".
1994-cü ildə BMT-nin Baş Assambleyası 16 sentyabr tarixini "Beynəlxalq Ozon Qatının Mühafizəsi Günü" elan edib. Bu gün ozon təbəqəsini dağıdan maddələrə dair imzalanan Monreal protokolunun tarixə salınması məqsədilə təyin olunmuş və dövlətlərə bu tarixi Monreal protokoluna uyğun fəaliyyətlərin təbliğatına həsr etmək təklif edilib. "Ozon təbəqəsinin qorunması haqqında" Vyana Konvensiyasında əks olunan və sonradan dağıdıcı xüsusiyyət daşıyan maddələrə dair Monreal protokolunda həyata keçirilən ozon təbəqəsinin qorunması beynəlxalq təşəbbüsdür. Protokolda iştirakçılar tərəfindən öhdəliyə götürülmüş müəyyən hədlər, ozondağıdıcı maddələrin istehsalı və istehlakının tamamilə dayandırılması müəyyən olunmuşdur. Bu gün Vyana Konvensiyasına 173 dövlət qoşulub. Ozon qatı Günəşdən gələn ultrabənövşəyi şüaları udur, onların yer səthinə çatmasının qarşısını alır. Ozon qatının dağılmasında "antropogen faktorun" rolu elmi dairələrdə daha çox təhlükə mənbəyi kimi müzakirə olunur.

Ruhban təbəqəsi
Ruhanilər — müəyyən bir din daxilində ruhaniliyi peşə olaraq icra edən bütün insanlara verilən addır. Əvvəlcə xristian terminologiyasına aid olan ruhanilik anlayışı bəzən digər dinlər üçün də istifadə olunur.
Ruhban insanlardan uzaqlaşaraq dünyanın ləzzətlərini tərk edən və ifrat şəkildə ibadət etməyə həsr olunmuş insanlar deməkdir. Ruhban və rahib eyni kökdən gələn ərəb dilli sözləridir.
İsa peyğəmbərin ölümündən sonra, bəzi xristianlar üzləşdikləri təzyiq və qəddarlıqlara görə ictimai həyatdan təcrid olundular və əldə etdikləri xüsusi yerlərə çəkildilər və özlərini ibadətə həsr etdilər. Bu təcrübə tədricən bir həyat tərzi olaraq xristianlıqda yerləşdi.
Bu gün məzhəblər arasında fərqlər olsa da, ruhanilərin yalnız kiçik bir hissəsi monastır həyatlarını davam etdirirlər.
Yalnız kişilər arasından seçilir.
Ruhanilər xüsusi bir dini təhsil alır,
Xüsusi geyimləri var,
Dini mərasimlərə rəhbərlik etmək və dini mətnləri şərh etmək səlahiyyəti verilmişdir, bəzi məzhəblərdə mərasimləri latın dili və yunan dili kimi dini mətnlərin ilk tərcümələrinin dillərində keçirirlər.
“Ruhaniliyi” bir “peşə” olaraq seçir, ömrü boyu özünü bu işə həsr edir, çörəyini bu işdən qazanır,
İyerarxik bir strukturda yerləşir, bu struktura zidd hərəkət edərsə, sanksiyalarla üzləşə bilər,
Dini təfsirlərdə, ictimai və siyasi mövzularda həmkarları və iyerarxik təşkilati quruluşla tam həmrəylik içində olacağı gözləntisi var.

Alüminium oksid
Alüminium oksid, Al2 O3 — alüminium və oksigenin kimyəvi birləşməsidir. Bir neçə alüminium oksid arasında ən çox rast gəlinən alüminium (III) oksid təyin edilmişdir. Ümumiyyətlə, alümina adlanır və ayrıca müəyyən forma və ya tətbiqlərə görə aloksid, aloksit və ya alundum da adlandırıla bilər. Təbii olaraq kristal polimorf fazasında α-Al2O3 mineral korund kimi meydana gəlir ki, bu da qiymətli daşlar yaqut və safirdir. Al2O3, sərtliyi sayəsində aşındırıcı və yüksək ərimə nöqtəsi sayəsində odadavamlı bir material olaraq alüminium metalının istehsalında əhəmiyyətlidir.
== Təbiətdə ==
Korund alüminium oksidin ən çox yayılmış təbii olaraq meydana gələn kristalformasıdır. Yaqut və sapfir korundun qiymətli keyfiyyətli formalarıdır. Yaqutlara xarakterik tünd qırmızı rəng və lazer keyfiyyəti xrom izləri ilə verilir. Safirlər dəmir və titan kimi fərqli rənglərdə olur. Son dərəcə nadir bir δ forması, deltalumit mineralı kimi meydana gəlir.
Kalsium-oksid
Əsasi oksiddir, turşu oksidləri və turşularla qarşılıqlı təsirdə olur.
1.CaO+CO2 → CaCO3
2.CaO+SO3 → CaSO4
3.CaO+H2SO4→ CaSO4+H2O
4.CaO+2HCl → CaCl2+H2O
Onu sənayedə əhəngdaşının parçalanmasından alırlar.
CaCO3→ CaO+CO2 ↑
CaO ağ rəngli, çətin əriyən (2570ºC temperaturda əriyir) maddədir. Onu su ilə reaksiyasından çoxlu istilik ayrılır. CaO-nun texniki adı “sönməmiş əhəng” olduğundan kalsium-oksidin su ilə qarşılıqlı təsirinə “əhəngin söndürülməsi” deyilir.
CaO+H2O→Ca(OH)2+Q
Kalsium –oksidin əsas etibarilə sönmüş əhəng Ca(OH)2, kalsium –karbid CaC2 almaq üçün istifadə edilir.

Sink oksid
Sink oksid ZnO (sinkit) - ağ rəngli qeyri-üzvi maddədir.
Suda həll olunmur, 1800 °C-ə qədər qızdırdıqda və sublimasiya zamanı saralır.
Altıbucaqlı, iysiz kristalik strukturu olan tozdur.
Sink hidroksidin parçalanması zamanı alınır:
Zn (OH)2→ ZnO + H2O (t=100-250°C).
Sinkin oksigenlə qarşılıqlı təsirindən alınır:
2Zn + О2 → 2ZnО
Həmçinin sink duzlarının parçalanması zamanı alınır.
Sink oksid amfoter oksidlərə aiddir. Turşularla reaksiya zamanı sink duzları alınır:
ZnO+2HCl→ZnCl2+H2O
Qələvilərlə reaksiya zamanı kaliun sinkat və su alınır:
ZnO+2KOH→K2ZnO2+H2O
ZnO + CoO → CoZnO2
Bor oksid və silisium dioksid ilə reaksiya zamanı şüşəyə oxşar boratlar və silikatlar alınır:
2ZnO + SiO2 → Zn2SiO4,
ZnO + B2O3 → Zn(BO2)2.
ZnO tibdə istifadə olunur.Sink oksidinin müasir tibbdə və kosmetologiyada geniş yayılması çoxfunksiyalılığı, geniş spektrli fəaliyyət və mükəmməl müalicəvi xüsusiyyətləri ilə əlaqədardır. Sink oksid tərkibli preparatlar yaxşı sakitləşdirici və müalicəvi xüsusiyyətlərə malikdir.
Toksikliyi
ZnO buxarı orqanizmə düşdükdə gözlərə və tənəffüs yollarına pis təsir edir, qıcıqlanma yarada bilər.

Dəmir (II) oksid
Dəmir (II) oksidi - dəmir (II) və oksigenin mürəkkəb qeyri-üzvi birləşməsidir. Təbiətdə vüstit mineralı kimi mövcuddur.
== Fiziki xassələri ==
Dəmir (II) oksid – qara rəngdə bərk birləşmədir. Yalnız yüksək temperaturda sabit vəziyyətdə olur.
== Alınması ==
Dəmir (III) oksidin hydrogen ilə reduksiyaedici reaksiyası zamanı almaq olar:
Fe2O3 + 3H2 → 2FeO + 3H2O
Dəmir (III) oksidin dəm qazı ilə reduksiyaedici reaksiyası zamanı:
Fe2O3 + CO → 2FeO + CO2
Dəmir(III) oksidin dəmir ilə reaksiyası zamanı:
Fe2O3 + Fe → 3FeO
Dəmirin oksigenlə aşağı təzyiq altında qızdırılması zamanı:
2Fe + O2 → 2FeO
Dəmir oksalatın vakuumda parçalanması zamanı:
FeC2O4 →t FeO + CO↑ + CO2↑
== Kimyəvi xassələri ==
Dəmir (II) oksid reaksiya zamanı əsası xassələr görsədir. Suda həll olunmur, oksidləşməyən turşularda asanlıqla həll olunur:
FeO + 2HCl → FeCl2 + H2O
Reduksiyaedici xassələr görsədir:
FeO + 4HNO3 → NO2 + Fe(NO3)3 + 2H2O
Dəmir(II) oksidin oksigenlə oksidləşmə reaksiyası:
4FeO + 3O2 → 2Fe2O3
Natriun hidroksidlə birgə əriməsı reaksiyası
FeO + 4NaOH →Na4FeO3 + 2H2O
Oksigenlə reaksiyası:
4FeO + 2nH2O + O2 → 2(Fe2O3 ⋅ nH2O)
6FeO + O2 →300−500 0C 2Fe3O4
Hidrogen sulfid ilə reaksiyası:
FeO + H2S →500 0C FeS + H2O
== Tətbiqi ==
Keramika və mineral boyaların tərkib hissəsi kimi istifadə olunur. E172 nömrəsi altında qida rəngi kimi qida sənayesində geniş istifadə olunur.
== Toksikliyi ==
Dəmir (II) oksidi zəhərli deyil. Buna baxmayaraq, dəmir (II) oksidin aerozollarına (toz, tüstü) uzun müddət məruz qaldıqdan sonra ağciyərlərdə çökür və pnevmokoniozun bir növü olan sideroza səbəb olur.
== Mənbə ==
Волков А. И., Жарский И. М. Большой химический справочник.

Germanium oksid (IV)
Germanium — oksidi (IV)
Germanium oksidi (IV) (germanium dioksid) germanium və oksigenin binar qeyri — üzvi kimyəvi birləşməsi olub amfoter oksiddir. Kimyəvi formulu GeO2 . Germanium – dioksidin forması silisium dioksidə çox oxşardır. İki kristallik və üçüncü amor modifikasiya halında mövcuddur :
Heksoqonal β- GeO2, α- kvars ilə eyni quruluşa malikdir.
Tetraqonal α- GeO2 (mineral forma argutit) SnO2 tipli struktura malikdir. Yüksək təzyiq altında CaCl2 tipli rombik formaya keçir.
Amorf GeO2 şüşəvari kvarsa bənzəyir, suda həll olandır.
Tetraqonal germanium dioksid 1033 °C -də heksoqonal formaya keçir. ∆Hα→ β=21,6kC/mol
== Alınması ==
Germanium dioksidi GeCl4 hidrolizə uğradıb, alınan çöküntünün 900°C-də qurutmaqla alınır. Bu zaman adətən amorf və heksoqonal GeO2 qarışığı alınır.

Manqan (III) oksid
Manqan (III) oksid — suda həll olmayan qeyri üzvi birləşmədir.
== Fiziki xassələri ==
Manqan (III) oksidi bir neçə modifikasiyada qəhvəyi-qara kristallar əmələ gətirir:
α-Mn2O3, rombik sinqoniya, kurnakit mineralı
β-Mn2O3, kuboid sinqoniya, mineral biksbiit
γ-Mn2O3, tetragonal sinongiya
== Alınması ==
Təbiətdə braunit, kurnakit və biksbiit mineralı kimi mövcuddur.
Manqan (III) oksidini oksidləşdirici-reduksiyaedici reaksiya zamanı almaq olar:
2 MnO 2 + Zn → Mn 2O3 + ZnO
Manqan(II) oksidin oksidləşməsi zamanı alınır:
4 MnO + O2 → 2 Mn2O3
Manqan(IV) oksidin reduksiyaedici reaksiyası zamanı alınır:
2 MnO2 + H2 → Mn2O3 + H2O
== Kimyəvi xassələri ==
Manqan (III) oksidi qızdırıldıqda parçalanır:
6
M
n
2
O
3
→
950
−
1100
o
C
4
M
n
3
O
4
+
O
2
{\displaystyle {\mathsf {6Mn_{2}O_{3}\ {\xrightarrow {950-1100^{o}C}}\ 4Mn_{3}O_{4}+O_{2}}}}
6
M
n
2
O
3
→
300
−
600
o
C
,
v
a
c
u
u
m
4
M
n
3
O
4
+
O
2
{\displaystyle {\mathsf {6Mn_{2}O_{3}\ {\xrightarrow {300-600^{o}C,vacuum}}\ 4Mn_{3}O_{4}+O_{2}}}}
Hidrogenlə reduksiya edilir:
M
n
2
O
3
+
H
2
→
300
o
C
2
M
n
O
+
H
2
O
{\displaystyle {\mathsf {Mn_{2}O_{3}+H_{2}\ {\xrightarrow {300^{o}C}}\ 2MnO+H_{2}O}}}
M
n
2
O
3
+
2
A
l
I
3
→
2
M
n
I
2
+
A
l
2
O
3
+
I
2
↑
{\displaystyle {\mathsf {Mn_{2}O_{3}+2AlI_{3}\ {\xrightarrow {}}\ 2MnI_{2}+Al_{2}O_{3}+I_{2}\uparrow }}}
ub>O
Turşularla reaksiya zamanı həm oksidləşdirici həm də reduksiyaedici xasissə göstərir:
2Mn2O3 + 8HNO3 → 4Mn(NO3)2 + O2 + 4H2O
2M2О3 + H2SO4 → MnSO4 + MnO2↓+ 2H2O
Metal oksidləri ilə əridildikdə, manqanit duzları əmələ gətirir:
Mn2O3 + ZnO → Zn[Mn2O4]
Mn2O3 + La2O3 → 2 La[MnO3]
Konsentrləşdirilmiş xlor turşusu ilə oksidləşdirici xüsusiyyətlərini göstərir:
Mn2O3+ 6HCl → 2MnCl2 + Cl2↑ + 3H2O
== Mənbə ==
Справочник химика / Редкол.: Никольский Б.П. и др.. — 2-е изд., испр. — М.-Л.: Химия, 1966. — Т. 1. — 1072 с.
Неорганическая химия / под ред. Ю.Д. Третьякова. — М.: Академия, 2007.

Mis (II)oksid
Mis (II) oksidi (mis oksidi) CuO – iki valentli mis oksididir. Qara kristaldır, normal şəraitdə olduqca sabitdir, suda həll olunmur. Təbiətdə tenorit (melakonit) mineralı kimi mövcuddur.
Mis (II) oksidi havada metalik misi qızdırmaqla (1100 ° C-dən aşağı olan temperaturda) almaq olar:
2Cu + O2 = 2СuО
Mis (II) hidroksidi, onun nitrat və ya karbonatını qızdırmaqla mis (II) oksidi almaq olar:
2Cu(NO3)2 → 2CuO + 4NO2 + O2
CuCO3 → CuO + CO2
Cu(OH)2 → CuO + H2O
Malaxiti qızdırmaqla CuO alınır:
Cu2CO3(OH)2 →2CuO + CO2 + H2O
Mis (II) oksid turşularla reaksiyaya qirərək mis (II) duzları və su əmələ qətirir:
CuO + 2HNO3 → Cu(NO3)2 + H2O
CuO qələvilərlə qarşılıqlı əritməklə kupratlar alınır:
CuO + 2KOH → K2CuO2 + H2O
11000C qədər qızdırılıqda mis və oksigen alınır. Mis (II) oksidə yaxın qələn mis (II) hidroksid zəif qələvidir. Qələvilərin qatı məhlulu ilə reaksiya zamanı hidrokso-kupratlar əmələ gəlir.
Cu(OH)2 + 2NaOH → Na2 [Cu(OH)2]
Mis (II) oksidi monoklin kristal sisteminə aiddir.
CuO, yaşıl və mavi rəng vermək üçün şüşə istehsalında istifadə olunur. Bundan əlavə, mis oksid mis — yaqut şüşələrin istehsalında istifadə olunur. Mis(II) oksidi quru batareyalar hazırlamaq üçün istifadə edilə bilər.

Qalay 4-oksid
Kassiterit və ya qalay 4-oksid (SnO2) — dördvalentli qalayın oksigenli birləşməsi.Qalay 4-oksid suda həll olmur, təbiətdə kassiterit mineralı şəklində tapılır, turşu və qələvi məhlullarının təsirinə qarşı müstəsna dərəcədə davamlıdır, karbon, hidroken və s. ilə asan reduksiya olunur. Sənayedə qalayı oksigendə yandırmaqla alınır. İstiyədavamlı minalar və qurğuşun-qalay şirləri hazırlanmasında işlədilir.

Renium VI oksid
Renium (VI) oksid ReO3 – qeyri-üzvi birləşmədir. Suda həll olmayan tünd-qırmızı kristallardır
Renim (VI) oksid kub sistemin tünd qırmızı paramaqnit kristallarını, fəza qrupu Pm3m, hüceyrə parametrləri a = 0.3734 nm,
Z = 1 əmələ gətirir.
Renium (VII) oksidin kommutasiya reaksiyası nəticəsində alınır:
3
R
e
2
O
7
+
R
e
→
250
−
300
o
C
,
N
2
7
R
e
O
3
{\displaystyle {\mathsf {3Re_{2}O_{7}+Re\ {\xrightarrow {250-300^{o}C,N_{2}}}\ 7ReO_{3}}}}
R
e
2
O
7
+
R
e
O
2
→
145
o
C
,
N
2
3
R
e
O
3
{\displaystyle {\mathsf {Re_{2}O_{7}+ReO_{2}\ {\xrightarrow {145^{o}C,N_{2}}}\ 3ReO_{3}}}}
Renium (VII) oksidin karbonmonooksidlə reduksiya nəticəsində:
R
e
2
O
7
+
C
O
→
T
o
C
2
R
e
O
3
+
C
O
2
{\displaystyle {\mathsf {Re_{2}O_{7}+CO\ {\xrightarrow {T^{o}C}}\ 2ReO_{3}+CO_{2}}}}
Renim (VI) oksid qızdırdıqda parçalanır:
3
R
e
O
3
→
300
o
C
,
v
a
c
u
u
m
R
e
O
2
+
R
e
2
O
7
{\displaystyle {\mathsf {3ReO_{3}\ {\xrightarrow {300^{o}C,vacuum}}\ ReO_{2}+Re_{2}O_{7}}}}
8
R
e
O
3
→
400
o
C
,
v
a
c
u
u
m
4
R
e
O
2
+
2
R
e
2
O
7
+
O
2
{\displaystyle {\mathsf {8ReO_{3}\ {\xrightarrow {400^{o}C,vacuum}}\ 4ReO_{2}+2Re_{2}O_{7}+O_{2}}}}
Qatı azot turşusu ilə oksidləşir:
R
e
O
3
+
H
N
O
3
→
H
R
e
O
4
+
N
O
2
↑
{\displaystyle {\mathsf {ReO_{3}+HNO_{3}\ {\xrightarrow {}}\ HReO_{4}+NO_{2}\uparrow }}}
Hava ilə təmasda olduqda oksidləşir:
4
R
e
O
3
+
O
2
→
160
−
400
o
C
2
R
e
2
O
7
{\displaystyle {\mathsf {4ReO_{3}+O_{2}\ {\xrightarrow {160-400^{o}C}}\ 2Re_{2}O_{7}}}}
Oksidləşdirici m::
2
R
e
O
3
+
H
2
O
2
→
2
H
R
e
O
4
{\displaystyle {\mathsf {2ReO_{3}+H_{2}O_{2}\ {\xrightarrow {}}\ 2HReO_{4}}}}
addələrin məhlulları ilə reaksiyaya daxil olduqda (azot turşusu, hidrogen peroksid, bromlu su və s.) renium turşusu alınır:
Hidrogenlə reduksiya olunur:
R
e
O
3
+
3
H
2
→
450
−
800
o
C
R
e
+
3
H
2
O
{\displaystyle {\mathsf {ReO_{3}+3H_{2}\ {\xrightarrow {450-800^{o}C}}\ Re+3H_{2}O}}}
Renium oksidləri katalizator kimi üzvi və qeyri-üzvi sintezdə istifadə olunur. Həm də metalurqiyada materialın fiziki və kimyəvi xüsusiyyətlərini yaxşılaşdıran bir komponent kimi istifadə olunur.
Справочник химика / Редкол.: Никольский Б.П. и др.. — 2-е изд., испр. — М.-Л.: Химия, 1966. — Т. 1. — 1072 с.
Справочник химика / Редкол.: Никольский Б.П. и др..
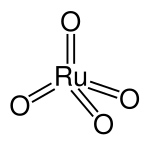
Rutenium (VIII)oksid
Rutenium (VIII) oksid – formulu RuO4 olan qeyri-üzvi birləşmədir.
Rutenium (VIII) oksid ilk dəfə Karl Klaus tərəfindən 1860-cı ildə kəşf edilmişdir.
Rutenum (VIII) oksid sarı-narıncı kristallar əmələ gətirir.
Rutenium tetraoksid uçucu birləşmədir və asanlıqla sublimasiya olur.
100 ° C-dən çox qızdırıldıqda, partlayışla parçalanır. Güclü oksidləşdirici maddədir, ozon qoxusu verir, spirt ilə reaksiyaya daxil olduqda partlayış baş verir.
Suda orta dərəcədə həll olunur, sulu məhlulları zəif bir turşudur pK1 =11.0.
Rutenium qızdırıldıqda oksigenlə oksidləşir:
R
u
+
2
O
2
→
1000
o
C
R
u
O
4
{\displaystyle {\mathsf {Ru+2O_{2}\ {\xrightarrow {1000^{o}C}}\ RuO_{4}}}}
Ruteniumun kalium bromat ilə oksidləşməsi nəticəsində:
5
R
u
+
8
K
B
r
O
3
+
4
H
2
S
O
4
→
80
o
C
5
R
u
O
4
+
4
B
r
2
+
4
K
2
S
O
4
+
4
H
2
O
{\displaystyle {\mathsf {5Ru+8KBrO_{3}+4H_{2}SO_{4}\ {\xrightarrow {80^{o}C}}\ 5RuO_{4}+4Br_{2}+4K_{2}SO_{4}+4H_{2}O}}}
Rutenium(IV) oksidi qızdırılaraq parçalanması nəticəsində:
R
u
O
2
+
O
2
→
700
−
1400
o
C
R
u
O
4
{\displaystyle {\mathsf {RuO_{2}+O_{2}\ {\xrightarrow {700-1400^{o}C}}\ RuO_{4}}}}
Kalium tetroksarutenatın (VI) xlor ilə oksidləşməsindən:
2
R
u
O
2
→
1300
o
C
R
u
+
R
u
O
4
{\displaystyle {\mathsf {2RuO_{2}\ {\xrightarrow {1300^{o}C}}\ Ru+RuO_{4}}}}
K
2
R
u
O
4
+
C
l
2
→
R
u
O
4
↓
+
2
K
C
l
{\displaystyle {\mathsf {K_{2}RuO_{4}+Cl_{2}\ {\xrightarrow {}}\ RuO_{4}\downarrow +2KCl}}}
Rutenum (VIII) oksid qızdırıldıqda parçalanır:
R
u
O
4
→
100
o
C
R
u
O
2
+
O
2
↑
{\displaystyle {\mathsf {RuO_{4}\ {\xrightarrow {100^{o}C}}\ RuO_{2}+O_{2}\uparrow }}}
Güclü oksidləşdiricidi. Xlorid turşusunun durulaşmış məhlulu ilə reaksiyaya daxil olur:
R
u
O
4
+
10
H
C
l
→
H
2
[
R
u
C
l
6
]
+
2
C
l
2
↑
+
4
H
2
O
{\displaystyle {\mathsf {RuO_{4}+10HCl\ \xrightarrow {} \ H_{2}[RuCl_{6}]+2Cl_{2}\uparrow +4H_{2}O}}}
4
R
u
O
4
+
32
H
C
l
→
2
(
R
u
C
l
3
⋅
R
u
C
l
4
]
↓
+
9
C
l
2
↑
+
16
H
2
O
{\displaystyle {\mathsf {4RuO_{4}+32HCl\ {\xrightarrow {}}\ 2(RuCl_{3}\cdot RuCl_{4}]\downarrow +9Cl_{2}\uparrow +16H_{2}O}}}
Qələvilərlə reaksiyaya daxil olur:
4
R
u
O
4
+
4
K
O
H
→
4
K
R
u
O
4
↓
+
O
2
↑
+
2
H
2
O
{\displaystyle {\mathsf {4RuO_{4}+4KOH\ {\xrightarrow {}}\ 4KRuO_{4}\downarrow +O_{2}\uparrow +2H_{2}O}}}
2
R
u
O
4
+
4
K
O
H
→
100
o
C
2
K
2
R
u
O
4
+
O
2
↑
+
2
H
2
O
{\displaystyle {\mathsf {2RuO_{4}+4KOH\ {\xrightarrow {100^{o}C}}\ 2K_{2}RuO_{4}+O_{2}\uparrow +2H_{2}O}}}
2
R
u
O
4
+
2
H
2
O
2
→
100
o
C
2
R
u
O
2
↓
+
3
O
2
↑
+
2
H
2
O
{\displaystyle {\mathsf {2RuO_{4}+2H_{2}O_{2}\ {\xrightarrow {100^{o}C}}\ 2RuO_{2}\downarrow +3O_{2}\uparrow +2H_{2}O}}}
Rutenium tetroksid çox zəhərli, uçucu, güclü oksidləşdirici maddədir, buna görə möhürlənmiş ampulalarda saxlanmalıdır.
Справочник химика / Редкол.: Никольский Б.П. и др..

İndium (III) oksid
Indium (III) oksid (İn2O3) – ikili qeyri-üzvibirləşmədir.
İndium(III)oksid amorf maddədir və ya açıq sarı kristallardır (qızdırdıqda qırmızı-qəhvəyi),kubik sinqoniyanın kristallarını əmələ gətirir, fəza qrupu a3, hüceyrə parametrləri a = 1,01194 nm, Z = 16. 6,5 GPa təzyiqdə və 300 -400 °C temperaturda altıbucaqlı qəfəsli fazaya keçir, normal şəraitdə sabitdir. Kristallar R 3c fəza qrupuna aiddir, hüceyrə parametrləri a = 0,5487 nm, c = 1,4510 nm, Z = 6, sıxlıq 7,3 q / sm³.
Oksigenin yüksək təzyiqindən 1910 °C-də əriyir və normal şəraitdə 850 °C-də asanlıqla buxar halına keçir və parçalanmağa başlayır.
1. Qızdırıldıqda indium bənövşəyi alovla yanır:
4
I
n
+
3
O
2
→
>
800
o
C
2
I
n
2
O
3
{\displaystyle {\mathsf {4In+3O_{2}\ {\xrightarrow {>800^{o}C}}\ 2In_{2}O_{3}}}}
2. İndium hidroksidinin termiki parçalanması nəticəsində:
2
I
n
(
O
H
)
3
→
350
o
C
I
n
2
O
3
+
3
H
2
O
{\displaystyle {\mathsf {2In(OH)_{3}\ {\xrightarrow {350^{o}C}}\ In_{2}O_{3}+3H_{2}O}}}
3. İndium nitratın, indium sulfatın parçalanması nəticəsində:
4
I
n
(
N
O
3
)
3
→
230
o
C
2
I
n
2
O
3
+
12
N
O
2
+
3
O
2
{\displaystyle {\mathsf {4In(NO_{3})_{3}\ {\xrightarrow {230^{o}C}}\ 2In_{2}O_{3}+12NO_{2}+3O_{2}}}}
4. İndium sulfidin oksidləşmə nəticəsində almaq olar:
2
I
n
2
S
3
+
9
O
2
→
650
o
C
2
I
n
2
O
3
+
6
S
O
2
{\displaystyle {\mathsf {2In_{2}S_{3}+9O_{2}\ {\xrightarrow {650^{o}C}}\ 2In_{2}O_{3}+6SO_{2}}}}
1. Qızdırıldıqda parçalanaraq buxarlanır:
I
n
2
O
3
←
→
1000
o
C
I
n
2
O
+
O
2
{\displaystyle {\mathsf {In_{2}O_{3}\ {\stackrel {\xrightarrow {1000^{o}C}}{\xleftarrow[{\ \ \ \ \ \ }]{}}}\ In_{2}O+O_{2}}}}
2. Qatı turşularla reaksiyaya daxil olur:
I
n
2
O
3
+
6
H
C
l
→
2
I
n
C
l
3
+
3
H
2
O
{\displaystyle {\mathsf {In_{2}O_{3}+6HCl\ {\xrightarrow {}}\ 2InCl_{3}+3H_{2}O}}}
3. Hidrogenlə metala gədər reduksiya olunur:
I
n
2
O
3
+
3
H
2
→
700
o
C
2
I
n
+
3
H
2
O
{\displaystyle {\mathsf {In_{2}O_{3}+3H_{2}\ {\xrightarrow {700^{o}C}}\ 2In+3H_{2}O}}}
4. Hidrogen sulfidlə reaksiyaya daxil olur:
I
n
2
O
3
+
3
H
2
S
→
500
o
C
I
n
2
S
3
+
3
H
2
O
{\displaystyle {\mathsf {In_{2}O_{3}+3H_{2}S\ {\xrightarrow {500^{o}C}}\ In_{2}S_{3}+3H_{2}O}}}
İndium(III)oksid yarımkeçirici material kimi istifadə olunur. Həmçinin xüsusi şüşələrin komponenti, neytron adsorbentləri kimi tətbiq olunur.
Лидин Р.А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов.

Neodim III oksid
Neodim oksid (Nd2O3) neodim əlvan metalının havada qızdırılması yolu ilə əldə edilir ki, həmin hava bunun hesabına çox tez qızır və qeyri-metallarla – azot, halogenlər, kükürd, hidrogen və digərləri ilə reaksiyaya daxil olur.
Xarici görünüşü – mavi, refrakter toz.
Elementin bütün tərkib hissələrindən ən çox onun oksidi əhəmiyyət kəsb edir, hansı ki bir sıra fiziki-kimyəvi xüsusiyyətli üstünlüklərə malikdir:
-ərimə temperaturu – 2200° C;
-qaynama temperaturu – 3300° C;
-suda və orta güclü mineral turşularda həll olunur;
-asan higroskopik material;
-soyuq su, alkalilər və ammonium hidratla reaksiyaya daxil olmur.
Onun təmizliyi 99%, 99,9%, 99,99%, 99,999% təşkil edir.
Neodim oksidin yaxşı xüsusiyyətlərinə görə, tətbiq sahəsi kifayət qədər genişdir. Hər şeydən çox keramika və şüşəəritmədə istifadə olunur. Neodim şüşəsi onun şüşə ərintilərinə daxil edilməsi yolu ilə əldə edilir. Belə şüşələr lazer və kosmik cihazlarda, yarımkeçirici lazerlərdə və inertial termoatom sintezi üçün multişüa sistemlərində istifadə olunur.
Neodim oksid dielektrik olaraq çox az genişlənmə əmsalı ilə istifadə olunur.
Onun istifadəsinə hətta gündəlik həyatda da rast gəlmək olar.
